Em uma decisão inédita, a Anvisa (Agência Nacional de Vigilância Sanitária) aprovou nesta quarta-feira (14) a liberação do uso medicinal do canabidiol, um dos 80 princípios ativos da maconha.
Com isso, o canabidiol sai de uma lista de substâncias proibidas no país e passa para uma lista de substâncias controladas.
| Editoria de Arte/Folhapress |
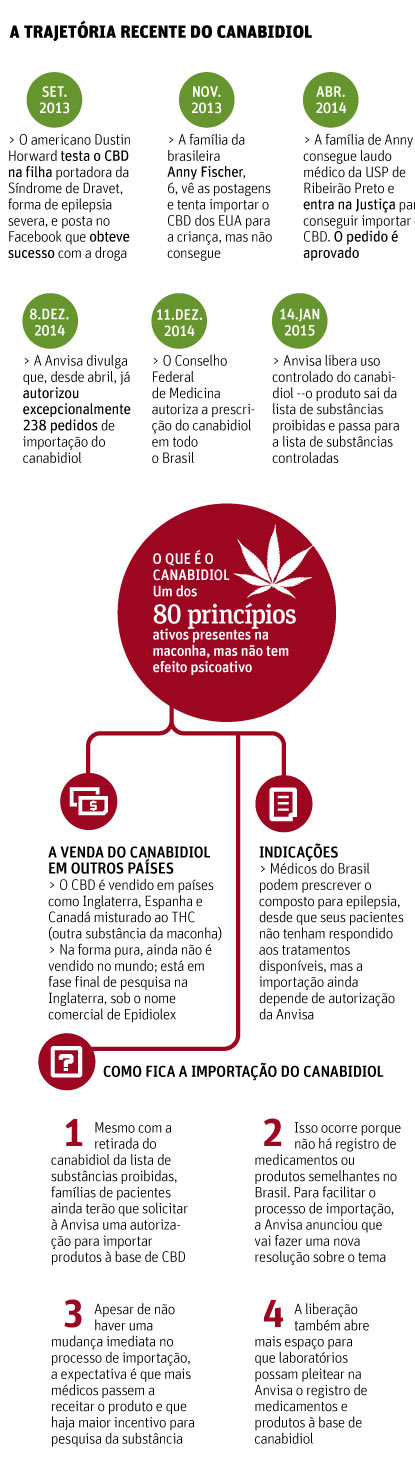 |
É a primeira vez que o órgão reconhece, oficialmente, o efeito terapêutico de uma substância derivada da cannabis. A mudança também abre espaço para laboratórios pesquisarem o canabidiol e solicitarem o registro de produtos e até remédios à base da substância no país.
A mudança foi aprovada por unanimidade. "É um momento histórico", disse um dos diretores do órgão, Ivo Bucaresky. Em seu parecer, os diretores citaram estudos que indicam que a substância, administrada principalmente por via oral, não apresenta risco de dependência e tem poucos efeitos adversos.
"A pergunta não é por que reclassificar, mas por que manter em uma lista de substâncias entorpecentes e psicotrópicas um produto que não tem essa propriedade", afirmou o diretor-presidente substituto da Anvisa, Jaime Oliveira.
A mudança faz com que o canabidiol passe das listas E e F2, que incluem substâncias como entorpecentes, para a lista C1, de substâncias controladas, como medicamentos cujo desenvolvimento e registro precisam de aprovação.
"É uma sinalização para a sociedade, pacientes e médicos de que esta substância não pode ser considerada tão nociva e sem efeitos terapêuticos como se imaginava", completa Oliveira.
Associações que reúnem famílias de pacientes com epilepsias graves e outras doenças comemoraram a mudança. "A Anvisa está dando uma contribuição histórica para aliviar o sofrimento de pacientes", disse Júlio Américo, presidente da Ama-me, associação de usuários de maconha medicinal.
"Estar na lista de proibidos passa para a sociedade a imagem de que é algo ruim. Reclassificar mostra que há outras opções de tratamento", disse Norberto Fischer, pai da menina Anny, 6, cuja história despertou o debate sobre o uso da maconha para fins medicinais no país, em 2014.
Apesar da mudança, famílias de pacientes ainda terão que solicitar à Anvisa autorização para importar produtos à base de canabidiol. Isso ocorre porque não há registro de medicamentos ou produtos semelhantes no Brasil.
Além disso, segundo a Anvisa, o pedido é necessário porque produtos conhecidos no mercado contêm outros canabinoides que continuam proibidos, entre eles o THC.
O órgão, no entanto, já planeja novas medidas para facilitar o processo de importação. A ideia é criar uma lista dos produtos mais utilizados e que terão liberação previamente autorizada.
A expectativa é que uma nova resolução sobre o tema fique pronta em até 30 dias.
ACESSO LEGAL
Para o psiquiatra José Alexandre Crippa, da USP de Ribeirão Preto e que estuda o uso do CBD, a decisão vai favorecer pesquisas e o acesso à substância. "Vamos passar a trabalhar com uma substância que não é ilegal", afirma.
A discussão sobre a retirada do canabidiol da lista de substâncias proibidas começou em maio do ano passado, depois que famílias como a da menina Anny entraram na Justiça para obter produtos à base de canabidiol e tratar casos graves de epilepsia.
| Sergio Lima/Folhapress | ||
 |
||
| Familiares exibem faixa pedindo a liberação do canabidiol em auditório na sede da Anvisa |
A Anvisa passou a liberar a importação em caráter excepcional –o órgão já liberou 336 pedidos. Em dezembro, o Conselho Federal de Medicina autorizou médicos a receitar produtos a base de CBD para tratamento de epilepsia em crianças e adolescentes.
Alguns médicos, porém, ainda tinham receio de fazer a prescrição, já que ainda não havia definição da Anvisa. "Agora, fica mais fácil para os médicos poderem prescrever", diz Ivo Bucaresky.
